LEITFADEN FÜR LEHRENDE
9. Schwangerschaftsberatung- und Schwangerschaftsbetreuung von Frauen mit Autoimmunerkrankungen
(Fortgeschritten)
Folie 2:
Definieren Sie die Ziele des Studienmaterials:
Informationen über die Immunologie der Schwangerschaft
Charakterisierung spezieller Gruppen von schwangeren Frauen mit Autoimmunerkrankungen
Eine Risikobewertung während der Schwangerschaft für Frauen mit Autoimmunerkrankungen vornehmen zu können
In der Lage zu sein, eine angemessene Beratung vor der Schwangerschaft durchzuführen
Ermittlung spezifischer Risiken und Präventivmaßnahmen
Folie 3:
Erklären Sie die geschlechtsspezifischen Unterschiede bei Autoimmunerkrankungen.
Autoimmunerkrankungen treten bei Frauen viel häufiger auf als bei Männern. Das Zusammenspiel von genetischen, umweltbedingten und hormonellen Faktoren beeinflusst die Entwicklung des Immunsystems. Die Unterschiede zwischen Männern und Frauen zeigen sich deutlich in der Anfälligkeit für Autoimmunerkrankungen, aber auch für Infektionskrankheiten und Krebsarten. Frauen unterscheiden sich von Männern in mehreren klinischen Merkmalen ihrer Immunreaktionen.
Folie 4:
Erläutern Sie die Epidemiologie von Autoimmunerkrankungen.
Frauen leiden häufiger an Autoimmunerkrankungen als Männer. Auf dieser Folie sehen wir die Häufigkeit einiger Autoimmunerkrankungen wie SLE, RA, autoimmune Schilddrüsenerkrankungen, entzündliche Darmerkrankungen, Vaskulitis und autoimmune Uveitis nach Geschlecht. Frauen scheinen anfälliger für die Entwicklung von Autoimmunerkrankungen zu sein als Männer.
Folie 5:
Das übliche Alter, in dem eine Autoimmunerkrankung bei Frauen diagnostiziert wird, überschneidet sich häufig mit dem Alter, in dem sie ein Kind bekommen. Dieses Schaubild zeigt, dass das gebärfähige Alter in der Regel von Jahr zu Jahr zunimmt, sodass mehr Frauen zum Zeitpunkt der Schwangerschaft an einer chronischen Krankheit leiden können (Diagramm OECD FAMILY DATABASE, oe.cd/fdb).
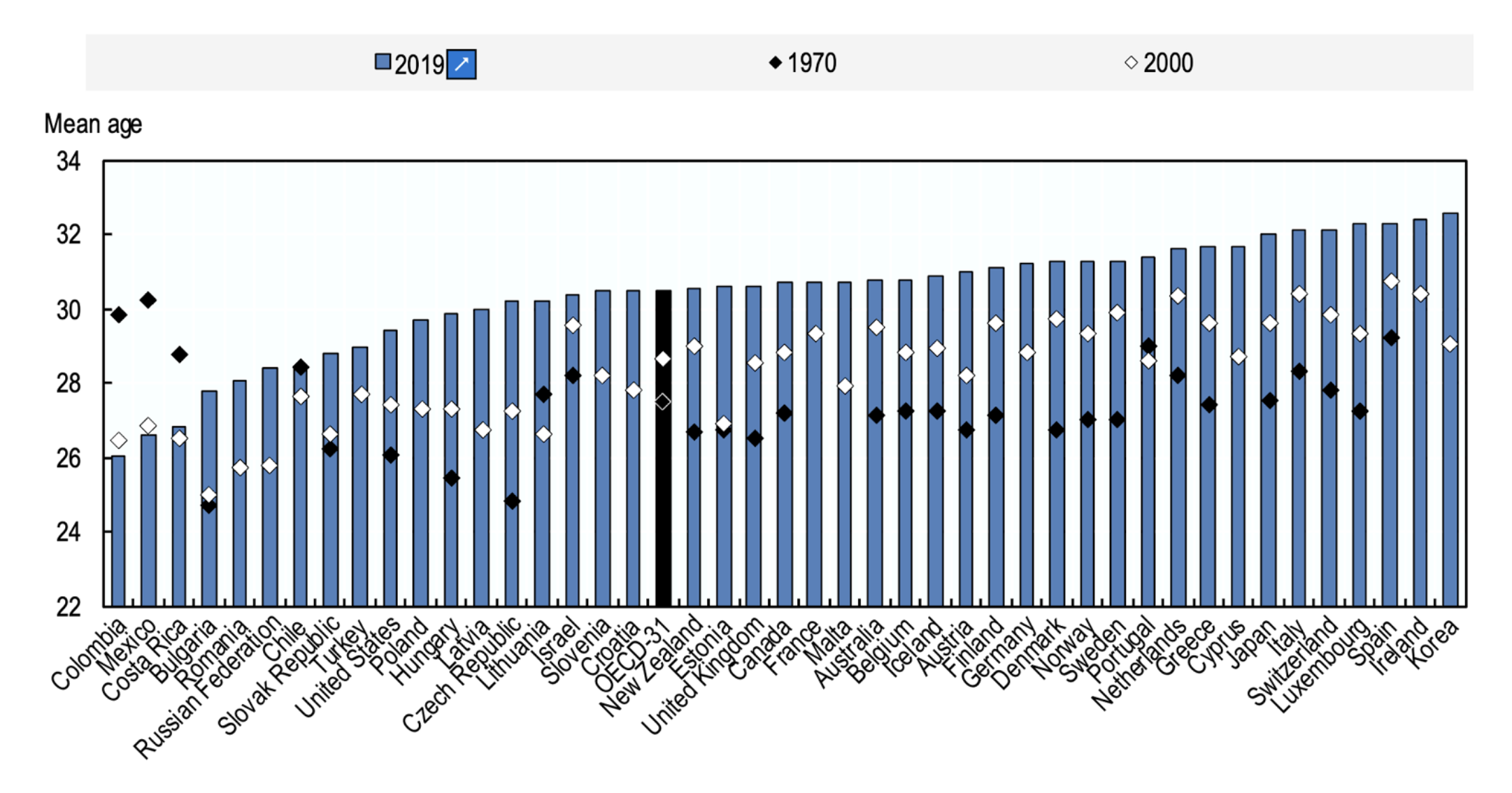
Dieser Trend ist auf gesellschaftliche Einstellungen und Erwartungen zurückzuführen, die das Fortpflanzungspotenzial von Frauen gefährden. In den meisten OECD-Ländern ist das Durchschnittsalter der Frauen bei der Geburt zwischen 1970 und 2019 um 2 bis 5 Jahre gestiegen, wobei der größte Anstieg (5,4 Jahre) in der Tschechischen Republik zu verzeichnen war. Mit Ausnahme von drei lateinamerikanischen Ländern (Kolumbien, Costa Rica und Mexiko), in denen das Durchschnittsalter der Frauen bei der Geburt seit 1970 um mehr als zwei Jahre gesunken ist.
Die Hauptreproduktionsjahre einer Frau liegen zwischen dem späten Teenageralter und den späten 20ern. Im Alter von 30 Jahren beginnt die Fruchtbarkeit (die Fähigkeit, schwanger zu werden) zu sinken. Dieser Rückgang beschleunigt sich, sobald sie 35 Jahre alt sind. Mit 45 Jahren hat die Fruchtbarkeit so stark nachgelassen, dass es für die meisten Frauen unwahrscheinlich ist, auf natürlichem Wege schwanger zu werden. Die Aufklärung über Fruchtbarkeitsaspekte scheint für die künftige Generation wichtig zu sein, damit sie ihr reproduktives Potenzial voll ausschöpfen kann.
Folie 6:
Dies ist ein weiteres Schaubild, das die steigende Zahl von Frauen erklärt, die mit Ende 30 gebären. Sie sehen, dass die Zahl der Geburten im Alter von über 35 Jahren zwischen 2004 und 2016 stetig ansteigt, was bedeutet, dass ein zunehmender Anteil der Frauen aufgrund ihres höheren Alters und ihrer Komorbiditäten sowie aufgrund des zunehmenden Einsatzes künstlicher Fortpflanzungstechniken ein geburtshilfliches Risiko aufweist. Das bedeutet aber nicht, dass die Fruchtbarkeit selbst nicht mit dem Alter abnimmt!
Folie 7:
Erklären Sie, warum ein fortgeschrittenes Alter in der Geburtshilfe ein Risiko darstellt.
Erläutern Sie die besonderen fetalen und mütterlichen Risiken von Schwangeren mit entzündlichen Autoimmunerkrankungen.
Folie 8:
Erklären Sie die Anpassung des Immunsystems an den semiallogenen Fötus.
Folie 11:
Welche Veränderungen treten im Immunsystem während der Schwangerschaft auf? Wie beeinflussen diese Veränderungen die Aktivität der Autoimmunerkrankung?
Erklären Sie die immunologischen Veränderungen während der Schwangerschaft. Es findet eine Verschiebung zwischen Th1- und Th2-Immunreaktionen statt, und die Th2-Dominanz ist charakteristisch für die Schwangerschaft. Diese immunologische Verschiebung trägt dazu bei, die entzündungshemmende Zytokinfunktion und damit die Aufrechterhaltung der Schwangerschaft zu begünstigen.
Erläutern Sie, wie sich die Autoimmunerkrankung auf die Schwangerschaft auswirken könnte und wie die immunologischen Veränderungen zu Veränderungen bei der zugrunde liegenden Autoimmunerkrankung führen könnten.
Folie 12:
Neue immunologische Studien haben gezeigt, dass bei der Betrachtung der immunologischen Veränderungen in der Schwangerschaft nach den drei Phasen der Schwangerschaft unterschieden werden muss. Eine entzündungsfördernde Mikroumgebung ist entscheidend für eine normale Einnistung und Geburt, während im Laufe der Schwangerschaft eine tolerogene Umgebung geschaffen wird, um eine normale Plazentation und ein normales Wachstum des Fötus zu ermöglichen. Die lokalen immunologischen Veränderungen in Plazenta und Dezidua sichern den Erfolg einer Schwangerschaft. Das Zytokinprofil in der Dezidua ist das Ergebnis des Zusammenspiels von fetalen Zellen und Hormonen, und das TH1-TH2-Paradigma sollte durch ein komplexeres Paradigma mit TH1-, TH2-, TH17- und Treg-Zellen ersetzt werden.
Die erste Phase beschreibt den Zeitraum von der Implantation bis zur frühen Plazentation. Zu diesem Zeitpunkt sind hauptsächlich angeborene Immunzellen wie NK-Zellen, dendritische Zellen, Makrophagen, Neutrophile und angeborene lymphatische Zellen vom Typ 3 (ILC3) für das proinflammatorische Immunmilieu verantwortlich, das aus IFNγ, IL-1, TNF, IL-6, IL-17 und dem Zytokin der IL-6-Familie, dem Leukämie-inhibierenden Faktor (LIF), besteht. Proinflammatorische M1-Makrophagen, die IL-23 oder IL-12 sowie LIF absondern; NK-Zellen aus der Dezidua sind kaum zytolytisch, produzieren aber Zytokine und Chemokine wie IFNγ und vaskulären endothelialen Wachstumsfaktor, die den Umbau der Spiralarterie fördern. Diese Faktoren sind für eine erfolgreiche Implantation unerlässlich.
Um eine Abstoßung an der feto-maternalen Schnittstelle zu vermeiden, entwickelt sich in der zweiten Phase der Schwangerschaft rasch ein tolerogener Zustand. Östrogen, Zellen und regulatorische Proteine wirken auf deziduale Stromazellen und tolerogene dendritische Zellen, erweitern FOXP3+ Treg-Zellen, verändern die Funktion der rasch zunehmenden Zahl natürlicher Killerzellen (NK) und regulieren Effektor-T-Zellen (Teff) herunter. Die Produktion entzündungshemmender Zytokine steigt. Infolgedessen wird der semiallogene Fötus toleriert.
In der dritten Phase der Schwangerschaft – bei der Geburt – ist wiederum eine entzündungsfördernde Mikroumgebung entscheidend. Zellen des angeborenen Immunsystems, wie Neutrophile und Makrophagen, infiltrieren die Dezidua und die Chorioamnionmembranen während der Geburt und sezernieren Matrixmetalloproteinasen, IL-1, IL-6, TNF und Stickstoffmonoxid.
Folie 12:
Alle oben genannten Veränderungen wirken sich auf die Aktivität der Autoimmunerkrankung während der Schwangerschaft aus. Gut kontrollierte Autoimmunerkrankungen bergen ein geringeres Risiko für eine Aktivität während der Schwangerschaft, während eine aktive Erkrankung während der Schwangerschaft ein Risiko für einen Krankheitsschub darstellt. Diese Besonderheit liegt in der Art der immunologischen Veränderungen während der Schwangerschaft.
Folie 13:
Erläutern Sie das Zusammenspiel von Schwangerschaft und Autoimmunerkrankungen am Beispiel der entzündlich-rheumatischen Erkrankungen (IRD), einer großen Gruppe verschiedener Autoimmunerkrankungen. Diese Krankheiten sind in der Regel systemisch und wirken sich daher auf die gesamte Immunreaktion der Patienten aus.
Wenn wir die Auswirkungen der IRD auf die Schwangerschaft und umgekehrt verstehen, können wir den Einfluss anderer systemischer Autoimmunerkrankungen auf den Verlauf der Schwangerschaft extrapolieren. Jede einzelne Autoimmunerkrankung kann jedoch spezifische Auswirkungen auf die Schwangerschaft haben. Leider ist es im Rahmen dieses Seminars nicht möglich, jede systemische Autoimmunerkrankung einzeln zu besprechen.
Wir werden uns auf den systemischen Lupus erythematodes und die rheumatische Arthritis als wichtige Beispiele für IRD in der Schwangerschaft konzentrieren. Organspezifische Autoimmunerkrankungen wie M. Basedow, Autoimmunthyreoiditis und Autoimmunhepatitis werden hier nicht behandelt.
Folie 14:
Erläutern Sie die Komplikationen im Zusammenhang mit der rheumatischen Grunderkrankung während der Schwangerschaft, z. B. Schübe, kardiale, pulmonale, hämatologische und renale Probleme. Bei einigen Patienten treten geburtshilfliche oder thrombotische Komplikationen oder beides im Zusammenhang mit Antiphospholipid-Antikörpern auf, die häufig mit Autoimmunerkrankungen einhergehen.
Erläutern Sie die Prävalenz von Schwangerschaftskomplikationen wie Frühgeburt, intrauterine Wachstumsrestriktion, kleinwüchsiges Neugeborenes und Präeklampsie bei Patientinnen mit rheumatischen Erkrankungen.
Erläutern Sie die Risikobewertung auf der Grundlage des Antiphospholipid-Antikörper-Screenings. Erläutern Sie das Syndrom, seine Diagnosekriterien und mögliche Risiken während und außerhalb der Schwangerschaft.
Folie 15:
Erläutern Sie anhand dieser Folie die Bedeutung der Schwangerschaftsberatung und -planung vor der Empfängnis. Diese Folie zeigt am Beispiel des SLE, wie sich die Aktivität der rheumatischen Grunderkrankung auf Schwangerschaftskomplikationen auswirkt. Wir sehen, dass eine hochaktive Autoimmunerkrankung das Risiko von Schwangerschaftskomplikationen erhöht.
Folie 16:
Erläutern Sie den Wert der Interdisziplinarität bei der Behandlung von schwangeren Frauen mit Autoimmunerkrankungen.
Eine Beratung vor der Schwangerschaft ist wichtig, um modifizierbare Risikofaktoren zu bewerten und die Krankheitsaktivität und die Therapie vor der Empfängnis zu optimieren.
Um den Verlauf der Schwangerschaft zu optimieren, sollten die folgenden Punkte beachtet werden:
Eine Risikomodifizierung durch angemessene Gewichtskontrolle, gesunde und ausgewogene Ernährung und Nikotinabstinenz
Überprüfung und Änderung der Medikation
Risikobewertung auf der Grundlage der Krankheitsaktivität, des Antikörperprofils und der geburtshilflichen Vorgeschichte
Es sollten wirksame Verhütungsmethoden vorgeschlagen werden, bis keine teratogenen Medikamente mehr verabreicht werden und bis die zugrunde liegende Autoimmunerkrankung für ca. 6 Monate einen stabilen Zustand in Remission erreicht hat.
Die Schwangerschaftsvorbereitung kann die Anpassung der immunsuppressiven Medikamente und einen erhöhten Bedarf an Folsäure beinhalten. Patienten nach einer Methotrexat-Therapie oder unter laufender Sulfasalazin-Therapie benötigen eine deutlich höhere Folsäuresubstitution (5 mg täglich). Die Substitution sollte vier bis zwölf Wochen vor dem Absetzen der Verhütung beginnen. Darüber hinaus sollte die Einnahme von Folsäure während der gesamten Schwangerschaft fortgesetzt werden, wenn Sulfasalazin während der Schwangerschaft eingenommen wird, und in den ersten 13 Schwangerschaftswochen, wenn Methotrexat vor der Schwangerschaft eingenommen wurde.
Außerdem ist es wegen des erhöhten Osteoporoserisikos sinnvoll, den Vitamin-D-Serumspiegel zu kontrollieren.
Der Impfstatus, einschließlich des Antikörpertiters, sollte ständig überprüft werden. Im Falle eines unzureichenden Schutzes gegen Varizellen, Röteln, Masern und Mumps sollte der Patient vor der Behandlung mit Immunsuppressiva mit einem Lebendimpfstoff geimpft werden.
Die Empfängnisverhütung darf erst einen Monat nach der Impfung unterbrochen werden. Die Grippe- und Keuchhustenimpfung (inaktivierter Impfstoff) wird während der Schwangerschaft immer empfohlen und sollte nach Möglichkeit im zweiten Trimester verabreicht werden.
Folie 17:
Erklären Sie, warum Antikörpertests für die Risikobewertung bei Schwangerschaften mit entzündlichen Autoimmunerkrankungen relevant sind.
Folie 18:
Für eine erfolgreiche präkonzeptionelle Beratung ist es entscheidend, dieses Syndrom rechtzeitig zu erkennen. Fragen nach einer Thrombose in der Vorgeschichte oder früheren Schwangerschaftskomplikationen wie Frühgeburt, Totgeburt, intrauterine Wachstumsbeschränkung, wiederholte Frühaborte oder Spätabtreibungen sind wichtig. Therapeutisch kann und sollte die APLAS in der Schwangerschaft mit Thrombozytenaggregationshemmern wie ThromboASS® und/oder niedermolekularen Heparinen behandelt werden.
Folie 19:
Erläutern Sie die Bedeutung von SSA/SSB-Antikörpern, die ein erhöhtes Risiko für neonatalen Lupus darstellen. Die Inzidenz des neonatalen Lupus ist selten (2 von 100 Patienten mit SSA/SSB-Antikörpern).
Folie 20:
Bei schwangeren Frauen mit SSA/SSB-Antikörpern im Zusammenhang mit dem Sjögren-Syndrom oder SLE besteht ein Risiko (ca. 2 %) für einen fetalen AV-Block. In der nachfolgenden Schwangerschaft ist das Risiko eines erneuten Auftretens mit schätzungsweise 20 % wesentlich höher.
Erläutern Sie mögliche Strategien zur Risikominderung und die Ergebnisse bei Kindern mit NLE.
Folie 21:
Erklären Sie die geburtshilflichen Risiken des SLE. Bindegewebserkrankungen wie SLE und Sjögren-Syndrom oder gemischte Bindegewebserkrankungen können mit mehr geburtshilflichen Komplikationen einhergehen. Aus diesem Grund ist eine Beratung vor der Schwangerschaft von größter Bedeutung.
Bei aktiver schwerer Erkrankung mit SLE ist die Frühgeburtenrate mit 58 % deutlich erhöht (vs. 8 % in der Kontrollgruppe) sowie andere Schwangerschaftskomplikationen.
Folie 22:
Erklären Sie, dass in seltenen Fällen eine Schwangerschaft kontraindiziert ist, da sie die werdende Mutter einem hohen Risiko für schwere Komplikationen aussetzt. Eine Schwangerschaft ist bei pulmonaler Hypertonie sowie aktiver neurologischer und renaler Beteiligung kontraindiziert, da die Sterblichkeit von Schwangeren in diesem Fall 20-mal höher ist.
Bei leichten Formen der Krankheit besteht keine Kontraindikation für eine Schwangerschaft, allerdings sollte sechs Monate vor der Empfängnis eine klinische Remission angestrebt werden.
Folie 23:
Besprechen Sie, dass die Vorbereitung auf die Schwangerschaft der Schlüssel zur Risikominderung ist.
Erläutern Sie die verschiedenen therapeutischen Eingriffe und ihre Auswirkungen auf den Fötus.
Folie 24:
Setzen Sie angeborene Fehlbildungen und frühe Fehlgeburten in einen Zusammenhang. Erläutern Sie die Hintergrundrisiken bei gesunden Schwangeren und setzen Sie diese in Beziehung zu den teratogenen Medikamenten. Erläutern Sie, welche Aspekte eines Medikaments das teratogene Potenzial beeinflussen (Halbwertszeit, Plazentaübergang, enzymatischer Abbau, Schwangerschaftswoche).
Wenn es unter diesen Therapien zu einer ungewollten Schwangerschaft kommt, ist eine professionelle Beratung erforderlich. Ein Schwangerschaftsabbruch ist immer eine individuelle Entscheidung, die auf einer interdisziplinären (Geburtshilfe, Rheumatologie, Embryologie) ausführlichen Beratung beruhen muss. Der genaue Zeitpunkt des Absetzens sowie die absoluten und relativen Risiken einer frühen Fehlgeburt und angeborener Fehlbildungen müssen angegeben werden.
Wie aus dieser Tabelle hervorgeht, sind die relativen Risiken für angeborene Fehlbildungen und Fehlgeburten im Vergleich zum Basisrisiko ohne Medikamente bei diesen Immunsuppressiva sehr unterschiedlich.
Folie 25:
Erörtern Sie sichere immunmodulatorische Arzneimitteloptionen.
Folie 26:
Bevor die Registerdaten verfügbar wurden, war es üblich, Frauen generell von der Einnahme von Biologika während der Empfängnis, der Schwangerschaft, der Stillzeit oder des Stillens abzuraten.
Häufige Fragen von Frauen, die eine Schwangerschaft mit TNF-alpha-Blockern planen, betreffen Infektionen des Neugeborenen und mögliche Missbildungen. Studien zeigen kein erhöhtes Risiko für Infektionen oder ein erhöhtes Auftreten von angeborenen Fehlbildungen.
Heute wissen wir, dass TNF-alpha-Blocker wie Certolizumab und Etanercept während der gesamten Schwangerschaft eingesetzt werden können. Für andere TNF-alpha-Blocker liegen weniger Daten über die Schwangerschaft vor, und sie können verabreicht werden, wenn der Nutzen bei einer bestimmten Patientin das Risiko des Medikaments überwiegt.
Folie 27:
Die fetale Immunität wird während der Schwangerschaft durch den Transfer von IgG-Antikörpern aus dem mütterlichen in den fetalen Kreislauf erworben. Von den fünf Hauptklassen von Antikörpern wird nur IgG über die Plazenta übertragen. Die Analyse von Nabelschnur-Seren hat gezeigt, dass alle IgG-Subklassen auf den Fötus übertragen werden, aber es wurde ein bevorzugter Transport von IgG1 festgestellt. Therapeutische monoklonale Antikörper (mAbs) gehören meist der IgG1-Unterklasse an, die am effizientesten zum Fetus transportiert wird.
Folie 28:
Bei allen Tierarten, die zur Prüfung der Entwicklungstoxizität verwendet werden, ist die fetale IgG-Exposition während der Organogenese sehr gering, steigt aber in der zweiten Hälfte der Trächtigkeit an, sodass das Neugeborene mit einer ähnlichen IgG1-Konzentration wie die Mutter geboren wird. Die Daten zeigen, dass die mütterlichen IgG-Konzentrationen im Blut des Fötus von Beginn des zweiten Trimesters bis zum Ende der Schwangerschaft ansteigen, wobei die meisten Antikörper im dritten Trimester erworben werden. Nur eine Restmenge an IgG1-Antikörpern passiert die Plazentaschranke während des ersten Trimesters. Daher haben sie keine teratogene Wirkung.
Folie 29:
Nach der Geburt werden erworbene IgG-Antikörper in den ersten 6–12 Monaten nach der Geburt langsam aus dem fetalen Kreislauf abgebaut.
Folie 30:
Aufgrund der anhaltenden Immunmodulation nach der Geburt ist bei der Lebendvirusimpfung daher Vorsicht geboten. Dies bedeutet, dass Lebendimpfstoffe erstmals 12 Monate nach der Geburt verabreicht werden können. Dies könnte BCG-, Rotavirus- und MMR-Impfungen betreffen.
Folie 31:
Zusammenfassend müssen wir uns darüber im Klaren sein, dass:
Jeder Patient mit einer Autoimmunerkrankung im fortpflanzungsfähigen Alter sollte auf die Familienplanung angesprochen werden.
Die Behandlung von Patienten vor/während der Schwangerschaft und Stillzeit sollte darauf abzielen, die Krankheitsaktivität bei der Mutter zu verhindern und den Fötus nicht zu schädigen.
Das Risiko einer medikamentösen Therapie für das Kind sollte gegen das Risiko einer unbehandelten mütterlichen Erkrankung für die Patientin und das Kind abgewogen werden.
Die Entscheidung über die medikamentöse Therapie sollte auf einer interdisziplinären und partizipativen Vereinbarung zwischen Rheumatologe, Gynäkologe und Patientin beruhen.
Views and opinions expressed are however those of the author(s) only and do not necessarily reflect those of the European Union or the Foundation for the Development of the Education System. Neither the European Union nor entity providing the grant can be held responsible for them.



